
研究内容
研究テーマ早わかり
分子から細胞まで「物質」と「生命」をつなぐ構造化学
生命現象を含む物質界の「しくみ」を解き明かそうとすると,結局分子の構造とダイナミズムの解明に行き着く.例えば化学反応の機構を理解しようとすると,反応中間体の構造がフェムト/ピコ秒の超短時間でどのように変化するのかを調べることが必須となる.当研究室では図1に示すように,構造化学,光分子科学,分子分光学,生物物理化学の4つの大きな領域にまたがって,分子を動的に観測,解析,理解するための新しい実験的,理論的方法論の開拓と,それを用いた様々な分子系の構造,ダイナミクス,機能の解明に向けた基礎研究を行っている.
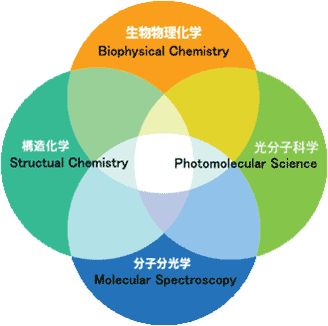
図1. 研究領域
反応中間体の動的構造(構造化学)
ピコ秒時間分解ラマン分光により観測されたS1状態のtrans-スチルベンのC=C2重結合伸縮バンドが,基底状態のものに比べて著しく幅広いことを見出し,スペクトル幅を決める振動位相緩和と反応中間体の高い反応性の相関に着想した.Kubo-Andersonのスペクトルバンド形の一般的理論を,2値交換の非対称極限に特化したバンド形の理論を構築した.この理論に基づいて,アルカン溶媒中のS1 trans-スチルベンのラマンバンド形を解析し,S1 trans-スチルベンが溶媒の揺動によって対イオンに分極する過程(図2,溶媒誘起動的分極)に関する定量的知見を得た.例えば,ヘキサン中ではW1=2.7×1012 s-1で,S1 trans-スチルベンは平均370 フェムト秒に1回分極する.多数のアルカン溶媒中,異なる温度で実験を行い,得られた分極速度W1が異性化反応速度と良い比例関係を持つことを明らかにした.この結果から,S1 trans-スチルベンの異性化は,図2のような動的分極を経て進行するという新しい反応概念を提出した.
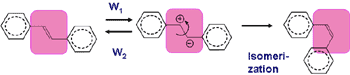
図2. 溶液中のS1 trans-スチルベンの動的分極
さらに最近,この理論を基底電子状態での熱反応に適用し,例えば1M硫酸中のt-ブチルアルコールが平均5ピコ秒に1回の割合でカルボカチオンに解離し,平均400フェムト秒で元に戻るという結果を得た.
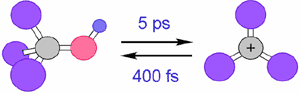
図3. 水溶液中のカルボカチオンの超高速生成/消滅ダイナミクス
超高速段階的2重プロトン移動反応機構の解明(光分子科学)
プロトンが一連のサイトを次々に移動するプロトンリレーは,多くの生物過程で重要な役割を果たしている.光誘起2重プロトン移動反応は,プロトンリレーの素過程として強い興味が持たれている.この2重プロトン移動が,協奏的(2つのプロトンが同時に移動)に進行するのか,段階的に進行するのかについては,この10年間大きな論争が続いていた.我々は,ピコ秒時間分解蛍光分光を用いて,2-アミノピリジン/酢酸系の光誘起2重プロトン移動による互変異性化反応の機構を調べ,励起直後に酢酸のプロトンが2-アミノピリジンの環窒素に移動してイオン中間体が生成し,続いて2-アミノピリジンのアミノ基のプロトンが酢酸アニオンに移動(ヘキサン中の時定数は5ピコ秒)して互変異性化が完了することを明らかにした(図4). また2番目のプロトン移動反応が熱的に進行することも明らかにしたが,アレニウスプロットから得られた活性化エネルギーにH/D同位体効果が見られなかった. この結果は,反応座標にプロトンの動きが含まれていないことを示唆しており,既存のどの理論でも説明がつかない. 現在,スチルベンの異性化反応と同様な溶媒誘起動的分極の考えを導入して解析を進めている.
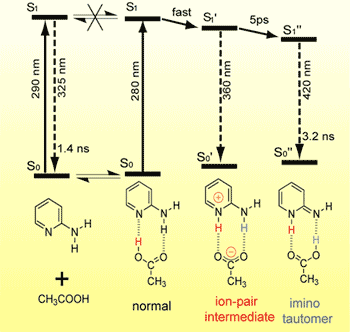
図4. 2-アミノピリジン/酢酸系の超高速光誘起2重プロトン移動
電場変調赤外分光法の開発(分子分光学)
電場変調赤外吸収分光は,外部から印加した電場によって誘起される赤外線吸収スペクトルの変化から,通常の赤外分光では得られない高次の分子情報を得るユニークな分光手法である.例えば,溶液中に存在する複数の化学種をその電気双極子能率の大きさに従って分別検出し,それぞれの電気双極子能率の大きさを決定することができる.このような重要性にも拘らず,技術上の困難が大きく,溶液・液体試料の電場変調赤外吸収測定は3000cm-1の高波数領域に限られていた.我々は,分散型分光器をAC結合検出方式と組み合わせた方式により,10-8の微小な吸光度変化を検出することができる新しい装置を開発した.その結果,指紋領域での溶液・液体試料の電場変調赤外分光を可能とした.この手法を1,4-ジオキサン中のN-メチルアセトアミドに適用し,2量体の電気双極子能率が単量体の約2倍となることを明らかにし,2量体がhead-to-tail型構造をとることを明らかにした.
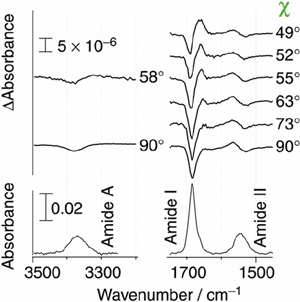
図6. 1,4-ジオキサン中のN-メチルアセトアミドの電場変調赤外スペクトル
「生命のラマン分光指標」の発見と細胞自然死過程の分子レベル追跡(生物物理化学)
分裂酵母(Schizosaccharomyces pombe)生細胞中のミトコンドリアのラマンスペクトルに,未知の分子種に由来する強いバンドを波数1602 cm-1に見出した.緑色蛍光色素(GFP)でミトコンドリアを標識した試料の測定から,この1602cm-1のバンドを与える分子種がミトコンドリアに局在することを証明した. KCN添加による呼吸阻害の実験,H2O2による酸化ストレスの実験から,このバンドがミトコンドリアの代謝活性を鋭敏に反映し,細胞の生命活性の良い指標となることを明らかにした.我々は1602cm-1のバンドを「生命のラマン分光指標」と呼んでいる.このバンドを与える分子種は,呼吸鎖中に存在する未知の反応中間体である可能性が高い.
出芽酵母(Saccharomyces cerevisiae)の液胞には,Dancing Body (DB)と呼ばれる顆粒が時折出現し,激しく動き回ることが知られている.我々は,DBが出現するとその後液胞が潰れ細胞内が無秩序になり,最終的に細胞死に至ることを見出した.この細胞死過程を,時間分解ラマンイメージングにより分子レベルで追跡した(図5). 波数1602 cm-1の“生命のラマン分光指標”のイメージから,0分から5時間50分の間では,ミトコンドリアが活発に代謝活動を行っており,リン脂質とタンパク質は液胞外に局在していることがわかる.6時間後,DBが突如出現し,それと共にミトコンドリアの代謝活性が著しく低下する.8時間41分後にはミトコンドリアの代謝活性が完全に消失し,分子レベルでは細胞が死んでいるとみなせるが,その他の物質分布は依然変化しない.9時間31分以後には,物質分布が乱雑になり,細胞がもはや生きていないことが明らかである.このようにして,ラマン分光によりDBの出現,それと同期したミトコンドリア代謝活性の消失,液胞の構造崩壊など一連の細胞自然死過程を時々刻々追跡することができた.この実験結果は,分子レベルで細胞死をどのように議論することができるかを考えるうえで大変興味深い.
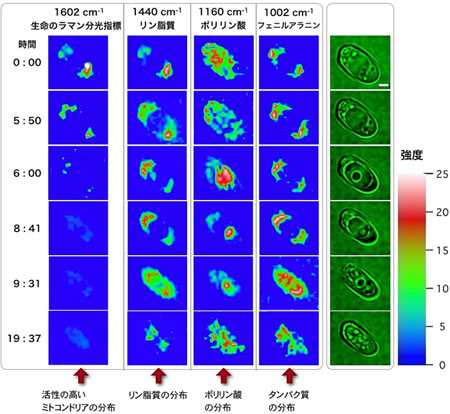
図5.出芽酵母の時間分解顕微鏡像およびラマンマッピング像